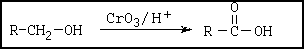Los alcoholes son compuestos orgánicos formados a partir de
los hidrocarburos mediante la sustitución de uno o más grupos hidroxilo por un
número igual de átomos de hidrógeno. El término se hace también extensivo a
diversos productos sustituidos que tienen carácter neutro y que contienen uno o
más grupos alcoholes.
Clasificación.
- De acuerdo al carbono enlazado:
Primarios: Un alcohol
es primario, si el átomo de hidrógeno (H) sustituido por el grupo
oxidrilo (-OH) pertenece a un carbón (C) primario, es decir un carbono con
unido a 2 átomos de hidrógeno:Secundarios: El átomo de hidrógeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un carbón (C) secundario, es decir un carbono unido a 1 átomo de hidrógeno:
Terciarios: El
átomo de hidrógeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a un
carbón (C) terciario, es decir un carbono solo:
- De acuerdo a la cantidad de grupos
hidroxilos:
Pueden ser monohidroxilicos (un grupo hidroxilo),
dihidroxilico (2 grupos hidroxilos) y trihidroxilico (3 grupos hidroxilos).
Nomenclatura.
- Regla 1: Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.
- Regla 2: Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
- Regla 3: El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por –o.
- Regla 4: Cuando en la molécula hay grupos funcionales de mayor prioridad, el alcohol pasa a ser un sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
- Regla 5: El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
Propiedades físicas.
Las propiedades físicas de un alcohol se basan
principalmente en su estructura. El alcohol está compuesto por un alcano y
agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un
alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua),
similar al agua. De estas dos unidades estructurales, el grupo –OH da a los
alcoholes sus propiedades físicas características, y el alquilo es el que las
modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es
capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con
otras moléculas neutras.
- Solubilidad: Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
A partir de 4 carbonos en la cadena de un alcohol, su
solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH),
polar, constituye una parte relativamente pequeña en comparación con la porción
hidrocarburo. A partir del hexanol son solubles solamente en solventes
orgánicos.
Existen alcoholes de cuatro átomos de carbono que son
solubles en agua, debido a la disposición espacial de la molécula. Se trata de
moléculas simétricas.
Existen alcoholes con múltiples moléculas de OH
(polihidroxilados) que poseen mayor superficie para formar puentes de
hidrógeno, lo que permiten que sean bastante solubles en agua.
- Punto de Ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
- ·Punto de fusión: Punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
- Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos.
Propiedades químicas.
Los alcoholes pueden comportarse como ácidos o bases, esto
gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula
de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto
se establece un dipolo.
La estructura del alcohol está relacionada con su acidez.
Los alcoholes, según su estructura pueden clasificarse como metanol, el cual
presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que
presentan dos o más moléculas de carbono.
- Oxidación:
La oxidación es la reacción de alcoholes para producir
ácidos carboxílicos, cetonas o aldehídos dependiendo del tipo de alcohol y de
catalizador, puede ser:
La reacción de un alcohol primario con ácido crómico
(CrO3) en presencia de piridina produce un aldehído:
La reacción de un alcohol primario en presencia del reactivo de jones produce un ácido carboxilo:
La reacción de un alcohol primario en presencia del reactivo de jones produce un ácido carboxilo:
- Deshidrogenación:
Los alcoholes primarios y secundarios cuando se calientan
en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar
aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire
(O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
- Halogenación:
El alcohol reacciona con el ácido hidrácido para formar
haluros de alquilo mas agua:
R-OH
+ HX -------------------) R-X +
H2O
- Deshidratación:
Es una propiedad de los alcoholes mediante la cual podemos
obtener éteres o alquenos:
2 R
-CH2OH ----------------) R - CH2 - O - CH2 - R'
R-R-OH ------------)
R=R + H2O
- Reacción con cloruro de tionilo: